Nhiều quá trình xảy ra xung quanh chúng ta là phản ứng oxi hóa khử. Chúng bao gồm quá trình đốt cháy, rỉ sét, quang hợp, hô hấp và phân hủy. Vậy phản ứng oxi hóa khử là gì? Cách cân bằng phản ứng oxi hóa khử mời các bạn tham khảo bài viết dưới đây.
Phản ứng oxi hóa khử là gì?
Phản ứng oxi hóa khử là phản ứng hóa học trong đó có sự chuyển electron giữa các chất, quá trình oxy hóa và quá trình khử xảy ra đồng thời. Do đó, phản ứng oxi hóa khử còn được gọi là phản ứng oxi hóa khử. Điều thú vị cần lưu ý là quá trình oxy hóa luôn đi kèm với quá trình khử. Quá trình oxy hóa và khử phải xảy ra đồng thời.
- Chất khử (chất bị oxi hóa) là chất nhường electron.
- Chất oxi hóa (chất bị khử) là chất nhận điện tử.
- Quá trình oxy hóa (oxy hóa) là quá trình mất electron.
- Giảm (khử) là quá trình thu được electron.
Xác định phản ứng oxi hóa khử
Bước đầu tiên trong việc cân bằng bất kỳ phản ứng oxi hóa khử nào là xác định xem đó có phải là phản ứng oxi hóa khử hay không. Điều này đòi hỏi một và thường là một số loài thay đổi trạng thái oxy hóa trong quá trình phản ứng. Để duy trì tính trung hòa điện tích trong mẫu, phản ứng oxi hóa khử bao gồm cả thành phần khử và thành phần oxy hóa.
Chúng thường được tách thành hai nửa phản ứng giả thuyết độc lập để làm cho phản ứng dễ hiểu hơn. Điều này đòi hỏi phải xác định nguyên tố nào bị oxy hóa và nguyên tố nào bị khử. Ví dụ, hãy xem xét phản ứng này:
Cu(s)+2Ag + (aq)→Cu 2+ (q)+ 2Ag(s)
Bước đầu tiên để xác định xem phản ứng có phải là phản ứng oxi hóa khử hay không là chia phương trình thành hai nửa phản ứng giả định. Hãy bắt đầu với nửa phản ứng liên quan đến các nguyên tử đồng:
Cu ( s ) →Cu2 + (aq )
Trạng thái oxy hóa của đồng ở phía bên trái là 0 vì bản thân nó là một nguyên tố. Trạng thái oxy hóa của đồng ở vế phải của phương trình là +2. Đồng trong nửa phản ứng này bị oxy hóa khi trạng thái oxy hóa tăng từ 0 ở Cu lên +2 ở Cu2 + . Bây giờ hãy xem xét các nguyên tử bạc
2Ag + (aq) → 2Ag(s)
Trong nửa phản ứng này, trạng thái oxy hóa của bạc ở bên trái là +1. Trạng thái oxy hóa của bạc ở bên phải là 0 vì đây là nguyên tố nguyên chất. Vì trạng thái oxy hóa của bạc thay đổi từ +1 thành 0 nên đây là phản ứng khử một nửa.
Do đó, phản ứng này là phản ứng oxi hóa khử khi xảy ra các nửa phản ứng oxi hóa khử và phản ứng khử (thông qua sự chuyển điện tử, không được thể hiện rõ ràng trong phương trình 2). Sau khi được xác nhận, thường cần phải cân bằng phản ứng (mặc dù phản ứng ở phương trình 1 đã cân bằng), việc này có thể được thực hiện theo hai cách vì phản ứng có thể diễn ra trong môi trường trung tính, axit hoặc bazơ.
Cân bằng phản ứng oxi hóa khử
Nguyên tắc: dựa trên sự bảo toàn electron nghĩa là tổng số electron trong chất cho phải bằng tổng số electron trong chất oxy hóa.
Các bước cân bằng:
- Bước 1: Viết sơ đồ phản ứng với các nguyên tố có sự thay đổi số oxi hóa.
- Bước 2: Viết các quá trình: khử (thu electron), oxi hóa (thu electron).
- Bước 3: Cân điện tử: nhân hệ số với:
- Tổng số electron cho = tổng số electron nhận.
- (tổng số oxi hóa giảm = tổng số oxi hóa tăng).
- Bước 4: Cân bằng nguyên tố không làm thay đổi số oxi hóa (thường theo thứ tự:
- Kim loại (ion dương):
- Gốc axit (ion âm).
- môi trường (axit, bazơ).
- Nước (cân bằng H 2 O để cân bằng hydro).
- Bước 5: Kiểm tra số nguyên tử oxy ở hai bên (phải bằng nhau).
Lưu ý: Khi viết các quá trình oxy hóa, khử của từng nguyên tố phải tuân theo chỉ số quy định của nguyên tố đó.
Phản ứng oxi hóa khử có thể giải thích dựa trên cơ sở
Mất hoặc tăng lượng oxy
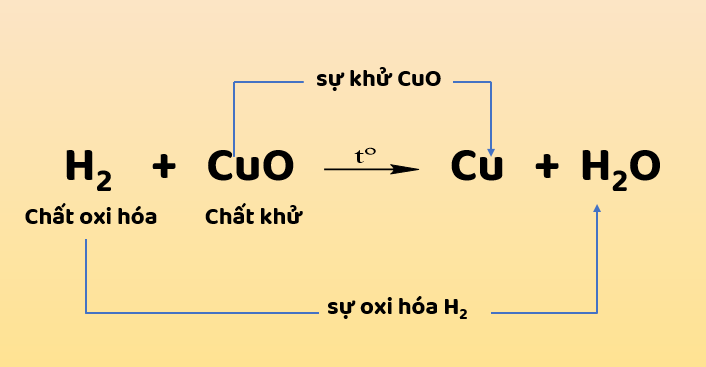
- Ban đầu, các nhà hóa học giải thích các phản ứng oxi hóa khử theo nghĩa là mất hoặc thu được oxy.
- Quá trình oxy hóa là sự gia tăng oxy. Vì vậy, khi một chất thu được oxy thì nó được cho là bị oxy hóa.
- Chất gây ra sự oxi hóa gọi là chất oxi hóa hay chất oxi hóa. Sự khử là đối nghịch của quá trình oxy hóa. Giảm là mất oxy. Vì vậy, khi một chất bị thiếu oxy, nó được cho là bị khử.
- Chất gây ra sự khử gọi là chất khử hoặc chất khử.
Sau đây là một phản ứng oxi hóa khử khác liên quan đến oxy.

(a) Kẽm bị oxy hóa vì nó nhận oxy để tạo thành oxit kẽm.
(b) Chì(II) oxit oxy hóa kẽm. Do đó chì(II) oxit là tác nhân oxy hóa trong phản ứng oxi hóa khử này.

(c) Đồng thời, chì(II) oxit bị khử khi nhường oxy cho kẽm. Nó bị khử thành chì kim loại.
(d) Kẽm có tác dụng khử chì(II) oxit. Do đó kẽm đóng vai trò là chất khử.
Mất hoặc thu được hydro
Không phải tất cả các phản ứng oxi hóa khử đều liên quan đến oxy. Đối với các phản ứng oxi hóa khử liên quan đến khí hydro hoặc các chất chứa hydro, việc giải thích quá trình oxy hóa và khử theo khía cạnh mất hoặc thu hydro sẽ dễ dàng hơn.
- Quá trình oxy hóa là sự mất hydro, còn sự khử là sự thu được hydro.
- Vì vậy, khi một chất mất hydro, nó được cho là bị oxy hóa.
Lấy phản ứng sau đây làm ví dụ.
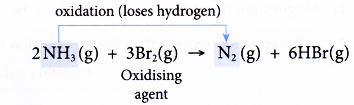
(a) Amoniac bị oxy hóa vì nó mất hydro thành khí nitơ.
(b) Brom là chất oxy hóa vì nó gây ra quá trình oxy hóa amoniac.
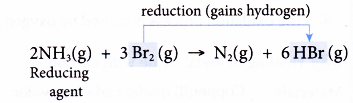
(c) Đồng thời, brom bị khử để nhận hydro bị mất bởi amoniac tạo thành hydro bromua.
(d) Amoniac là chất khử vì nó gây ra tính khử của brom.
Xét phản ứng giữa hydro sunfua và clo để tạo ra lưu huỳnh và hydro clorua.

(a) Hydro sunfua bị oxy hóa thành lưu huỳnh vì nó mất hydro thành clo.
(b) Clo tạo ra hydro và bị khử thành hydro clorua.
(c) Clo đóng vai trò là chất oxy hóa vì nó làm oxy hóa hydro sunfua.
(d) Hydro sunfua đóng vai trò là chất khử vì nó làm khử clo.
Sự chuyển electron
Nhiều phản ứng oxi hóa khử không có oxy hoặc hydro. Những phản ứng này có thể được giải thích bằng sự chuyển điện tử đã xảy ra.
Sự oxi hóa là sự nhường electron, sự khử là sự nhận electron.
Do đó, chất nhận điện tử đóng vai trò là chất oxy hóa và chất cho điện tử đóng vai trò là chất khử.
Hãy xem xét phản ứng sau đây.

(a) Trong phản ứng này, có sự chuyển electron từ natri sang clo.
(b) Phản ứng này có thể được coi là hai biến đổi riêng biệt xảy ra đồng thời. Mỗi sự thay đổi được gọi là một nửa phản ứng và phương trình của nó được gọi là một nửa phương trình.
Nửa phương trình oxi hóa:
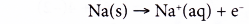
Mỗi nguyên tử natri bị oxy hóa khi mất đi một electron để tạo thành ion natri.
Phương trình nửa giảm:
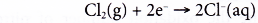
Mỗi phân tử clo bị khử khi nhận hai electron từ nguyên tử natri để tạo thành hai ion clorua.
(c) Natri là chất cho electron nên là chất khử. Ngược lại, clo là chất nhận điện tử. Vì vậy clo đóng vai trò là chất oxi hóa.
(d) Chúng ta có được phương trình tổng thể bằng cách cộng hai nửa của phương trình.
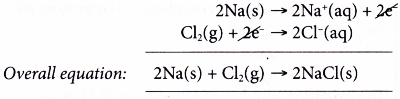
Thay đổi số oxi hóa
Sự chuyển electron hoàn toàn xảy ra trong các phản ứng oxi hóa khử có sự tham gia của các ion. Tuy nhiên, có những phản ứng oxi hóa khử liên quan đến các phân tử không liên quan đến việc chuyển electron hoàn toàn.
Những phản ứng oxi hóa khử như vậy có thể được giải thích bằng sự thay đổi số oxi hóa.
Số oxi hóa hoặc trạng thái oxy hóa của một nguyên tố là điện tích mà nguyên tử của nguyên tố đó sẽ có nếu sự chuyển electron hoàn toàn diễn ra.
Mỗi nguyên tố của một chất có thể được gán một số oxi hóa. Các nhà hóa học chỉ định số theo một bộ quy tắc.
Quy tắc 1: Số oxi hóa của nguyên tử ở trạng thái nguyên tố bằng 0. Ví dụ: C, Na, Mg, Al, H 2 , O 2 , Cl 2 và Br 2 có số oxi hóa là 0.
Quy tắc 2: Số oxi hóa của ion đơn nguyên tử bằng điện tích của nó.
Câu 3: Trong hợp chất, nguyên tố có độ âm điện lớn nhất có số oxi hóa âm hơn.
Vì vậy, các quy tắc sau đây được thông qua.
(a) Số oxi hóa của flo trong tất cả các hợp chất của nó là -1 vì nó có độ âm điện rất lớn.
(b) Số oxi hóa của các halogen khác (clo, brom và iốt) trong hợp chất của chúng là -1 trừ khi chúng kết hợp với các nguyên tố có độ âm điện lớn hơn như oxy và nitơ.
(c) Số oxi hóa của hydro trong hợp chất luôn là +1 , trừ khi hydro kết hợp với kim loại để phản ứng tạo thành hydrua kim loại, trong đó nó là -1.
(d) Số oxi hóa của oxy trong các hợp chất luôn là −2 , ngoại trừ peroxit và khi oxy kết hợp với một nguyên tố có độ âm điện lớn hơn như flo.
- Quy tắc 4: Tổng số oxi hóa của tất cả các nguyên tố trong công thức của hợp chất phải bằng 0.
- Quy tắc 5: Tổng số oxi hóa của tất cả các nguyên tố trong công thức của ion đa nguyên tử phải bằng điện tích của ion đó.
Các loại phản ứng oxi hóa khử
Không phải tất cả các phản ứng hóa học đều là phản ứng oxi hóa khử. Ví dụ, phản ứng axit-bazơ và phân hủy kép (như kết tủa) là những phản ứng không oxi hóa khử.
Bốn ví dụ về phản ứng oxi hóa khử là:
(a) Sự biến đổi ion sắt (II) thành ion sắt (III) và ngược lại
b) Sự dịch chuyển của kim loại ra khỏi dung dịch muối của nó
(c) Sự dịch chuyển halogen ra khỏi dung dịch halogenua của nó
(d) ) Chuyển electron ở khoảng cách xa